- Au début notre sommeil est léger, l'activité de notre cerveau se ralentit mais nous sommes encore très réceptif au bruit et à tout ce qui peut perturber notre sommeil. Nous appelons ce sommeil le sommeil lent léger.
- Puis, progressivement, nous nous coupons de plus en plus du monde extérieur. L'activité de notre cerveau se ralentit toujours plus. C'est ce que nous appelons le sommeil lent profond. Ce sommeil est indispensable à la récupération de notre fatigue physique ....
- Toutes les 90 minutes environ, survient un type de sommeil particulier, que noue appelons le sommeil paradoxal. En effet, l'activité de notre cerveau y est intense mais notre sommeil est très profond et notre corps presque totalement paralysé. C'est le moment des rêves et nous y récupérons de toute la tension nerveuse de notre journée précédente.
- La fin d'un cycle de sommeil est marquée par le sommeil paradoxal puis nous replongeons dans un nouveau cycle de sommeil ou bien nous nous réveillons, après une petite période intermédiaire de sommeil lent léger. En effet, le sommeil lent profond prédomine en début de nuit et le sommeil paradoxal est plus long, plus important en fin de nuit, au petit matin.
- Du soir au matin , nous sommes tous différents. En moyenne, nous dormons environ 8 heures par nuit mais pour certains 5 heures de sommeil suffisent : ce sont les "petits dormeurs", d'autres ont besoin de 9 à 10 heures de sommeil : ce sont les "gros dormeurs". Certains sont "du matin", d'autres "du soir". Ces besoins en sommeil différents d'un sujet à l'autre sont génétiquement déterminés et hérités de nos parents. En fait, le seul signe d'un sommeil suffisant est de se sentir en bonne forme dans la journée. Notre besoin fondamental en sommeil se heurte malheureusement le plus souvent aux exigences et aux contraintes de notre vie socio-professionnelle. Si ces conflits sont trop importants ou trop répétés, nous risquons de dégrader nos rythmes biologiques et sensation de fatigue, de malaise, insomnie et dépression peuvent être la cause de ce surmenage. C'est ce qui nous arrive le plus souvent quand notre vie professionnelle nous oblige à un travail de nuit ...
Il faut savoir aussi que l'âge est un facteur important dans l'organisation de notre sommeil. Il est évident qu'un enfant ne dort pas comme une personne âgée. Vers 50 ans, en général, le temps de sommeil diminue et l'on se réveille plus tôt. Nous supportons aussi beaucoup moins bien les changements de rythme. Nous nous remettons facilement d'une nuit blanche à 20 ans .... beaucoup moins à 50 ans. Notre sommeil s'allège. Les éveils nocturnes sont plus fréquents et les réendormissements plus difficiles. Et, plusieurs éveils nocturnes donnent souvent l'impression de ne pas avoir fermé l'oeil de la nuit ...
Cette évolution est normale et la prise inconsidérée de somnifère n'arrange rien ... bien au contraire.
Certaines règles élémentaires peuvent suffire à améliorer la qualité de la nuit et donc ... de la vie.
L'HOMÉOSTASIE - FONDEMENT THÉORIQUE DE LA PHYSIOLOGIE DES RÉGULATIONSLes différentes cellules de l'organisme puisent les matériaux indispensables à leur métabolisme et rejettent les produits de leur sécrétion dans le milieu intérieur, doué d'une certaine constance. La constance du milieu intérieur, indispensable à la survie de l'organisme, repose, de fait, sur le contrôle d'un certain nombre de variables dites régulées, dont les plus importantes sont le contenu en gaz du sang, l'acidité ou pH, la température, la glycémie, la pression artérielle et la pression osmotique. Chaque fois que sous l'influence de variations du milieu extérieur, une variable du milieu intérieur s'écarte de sa valeur normale, s'enclenchent des mécanismes régulateurs.
Ces mécanismes régulateurs sont de deux ordres : hormonaux et comportementaux.
Si, par exemple, un animal perd de l'eau (déshydratation par grande chaleur), la concentration en sodium du milieu intérieur et donc la pression osmotique augmentent. La pression osmotique, variable régulée, est alors maintenue constante par la mise en jeu de mécanismes régulateurs, qui vont freiner les sorties et/ou augmenter les entrées d'eau : la sécrétion d'hormone antidiurétique, variable contrôlée, va augmenter provoquant une diminution de l'excrétion rénale et donc une diminution des sorties d'eau; l'élévation de la pression osmotique déclenche parallèlement une sensation de soif et le besoin de boire amenant une augmentation des entrées d'eau.
LA VIGILANCE - GARDIENNE DE NOTRE HOMÉOSTASIE
Notre présence au monde, soit notre capacité de réagir au monde extérieur, dépend de notre niveau de vigilance. Celle-ci assure notre plus ou moins grande aptitude à la perception consciente et au traitement de l'ensemble des informations en provenance de notre environnement conduisant à la réalisation de comportements adaptés, nécessaires à la conservation de l'individu et de l'espèce.Il existe déjà à l'éveil, différents niveaux de vigilance, de la somnolence postprandiale à l'attention sélective. De même, nous dormons plus ou moins profondément. Il existe donc toute une gamme physiologique de niveaux de vigilance. Eveil - Sommeil - Rêve sont trois états éloignés d'une même fonction : la fonction de vigilance. Ces trois états de vigilance répondent eux mêmes à des mécanismes de régulation homéostatiques.Homéostasie réactive: l'éveil conduit au sommeil et la qualité de notre sommeil conditionne la qualité de notre éveil; le sommeil prépare le rêve. Plus l'éveil est long et intense, plus le sommeil récupérateur sera long et intense. La phase de sommeil lent, qui précède la phase de rêve, permet la constitution des ressources énergétiques nécessaires à la survenue du rêve. - Homéostasie prédictive : la fluctuation des états de vigilance au cours du nycthémère est la manifestation la plus spectaculaire des rythmes biologiques, circadiens et ultradiens qui conditionnent les changements rythmiques de nos constantes biologiques et de nos comportements.
L'ÉLECTRO - ENCÉPHALOGRAMME
Notre niveau de vigilance est apprécié par l'électroencéphalogramme (EEG) ou enregistrement des activités électriques corticales au moyen d'électrodes de surface posées sur le scalp. Les activités électriques corticales sont liées à l'architecture du cortex et à la connectivité corticale, soumise à un ensemble de règles d'organisation communes à l'ensembles du cortex.1. ARCHITECTURE ET CONNECTIVITÉ DU CORTEX
Les afférences en provenance des noyaux spécifiques du thalamus se terminent préférentiellement au niveau de la couche IV. Les afférences en provenance des autres régions corticales (fibres d'association - fibres commissurales) (afférences corticocorticales) se terminent préférentiellement dans les couches superficielles du cortex.Les cellules pyramidales de la couche III donnent naissance aux fibres corticocorticales. Les grandes cellules pyramidales de la couche V (cellules de Betz) donnent naissance aux fibres corticospinales. Les cellules pyramidales de la couche VI donnent naissance aux fibres corticothalamiques.
Il existe donc une relation bidirectionnelle très importante entre le thalamus et le cortex et une organisation verticale "en colonnes", perpendiculaire à l'organisation laminaire, du traitement de l'information. Cette organisation verticale est due à la présence d'interneurones inhibiteurs GABA dont les axones sont plutôt horizontaux et touchent essentiellement la partie basale des cellules pyramidales.
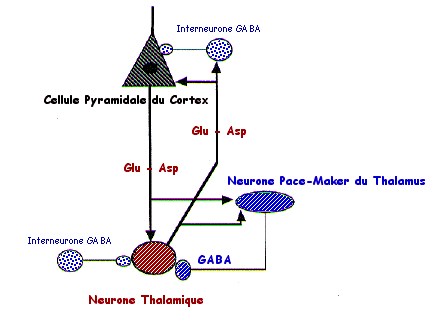
2. MECANISMES CELLULAIRES SOUS-TENDANT L'ACTIVITÉ EEG
L'activité EEG correspond essentiellement à l'activité postsynaptique des cellules pyramidales corticales. Elle résulte de l'orientation parallèle des dendrites des cellules pyramidales : les courants locaux venant de dipôles orientés parallèlement s'ajoutent. Elle représente l'addition des courants locaux d'une très large population de cellules pyramidales. Elle est donc essentiellement sous le contrôle des structures sous-corticales, qui se projettent au niveau cortical.3. LES ACTIVITÉS EEG SPONTANÉES
Les activités cérébrales sont caractérisées par leur fréquence, leur amplitude, leur morphologie, leur stabilité, leur topographie et leur réactivité. Elles sont classées en fonction de leur bande de fréquence.- Activités Bêta fréquence : 14 - 45 Hz
Activités Alpha fréquence : 8 - 12 Hz Occipitales Yeux Fermés Bloquées par l'ouverture des yeux
Activités Thêta fréquence : 4 - 8 Hz
Activités Delta fréquence : < 3,5 Hz
Chez l'adulte sain éveillé, l'activité EEG est constituée principalement de 2 rythmes alpha et bêta. On peut noter de manière physiologique des activités thêta et delta, dont l'importance varie en fonction de l'âge et du niveau de vigilance.
L'activité EEG constitue un biorythme influencé par l'environnement externe et interne du sujet, qui varie au cours du nycthémère et se modifie en fonction de l'âge.
LA POLYGRAPHIE DE SOMMEIL
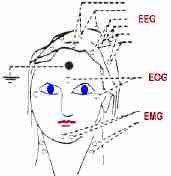
Chez l'homme, l'enregistrement de milliers de polygraphies de sommeil nocturne a permis d'établir le profil typique d'une nuit de sommeil d'un adulte jeune.
Sur la base des modifications :
- de l'activité électrique corticale (électroencéphalogramme : EEG),
- de l'activité électrique des muscles de la houppe du menton (électromyogramme : EMG)
- de la présence ou non de mouvements oculaires (électro-oculogramme : EOG)
- des modifications des rythmes cardiaque (Fc) et respiratoire (Fi)
En effet, le sommeil lent se caractérise par un ralentissement progressif de l'activité électrique corticale, synchrone d'une augmentation d'amplitude des ondes EEG enregistrées.
Le sommeil paradoxal se caractérise, au contraire, par une activité corticale rapide et peu ample, proche de celle de l'éveil.
En pathologie, il est possible d'enregistrer simultanément nombre de paramètres adaptés à la recherche et au diagnostic de l'affection suspectée comme :
- le flux naso-buccal et
- la saturation en oxygène à la recherche d'un syndrome d'apnées du sommeil
- l'activité électrique des muscles jambiers antérieurs à la recherche de mouvements d'impatience des jambes dans le sommeil
- la pression oesophagienne à la recherche d'un syndrome de résistance des voies aériennes supérieures...
La phase d'éveil calme, pendant laquelle le sujet est détendu et les yeux fermés.
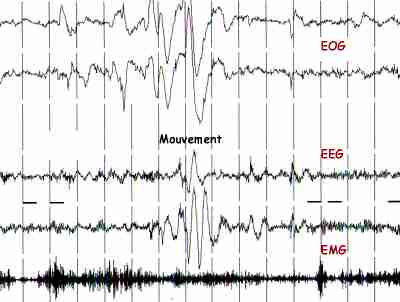
- EEG : Activité de type Alpha (10 - 12 cps) postérieure
- EMG : Activité tonique des muscles posturaux de la nuque ou de la houppe du menton riche
- EOG : Présence de mouvements oculaires sporadiques vers la droite ou la gauche
- Fi et Fc : Les fréquences cardiaque et respiratoire sont relativement stables.
LE SOMMEIL LENT LÉGER
L'ENDORMISSEMENT OU PHASE I DE SOMMEIL LENT LÉGER
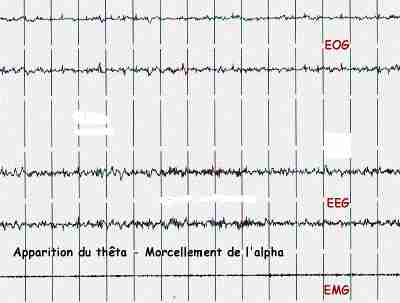
- EEG : L'activité EEG de type alpha laisse place une activité plus lente de la bande thêta ( 4 à 6 cps).
- EMG : Le tonus musculaire diminue légèrement, mais apparaît encore nettement
- EOG : Quelques mouvements oculaires sporadiques peuvent persister.
- Fi et Fc : La fréquence cardiaque diminue légèrement et reste régulière. La fréquence respiratoire est assez souvent irrégulière, pseudo-périodique. avec quelques apnées d'une dizaine de secondes
LA PHASE II DE SOMMEIL LENT LÉGER
Surviennent dans cette phase de sommeil lent des activités électriques corticales caractéristiques, qui sont les fuseaux de sommeil et les complexes K. Ces activités électriques corticales sont le signe de la mise en route de circuits thalamo-corticaux.
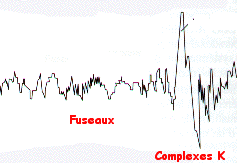
- EEG : Activité de la bande thêta (4 - 6 cps) surchargée de fuseaux de sommeil et de complexes K
- EMG : Le tonus musculaire, persistant, est très diminué
- EOG : Les mouvements oculaires disparaissent
- Fi et Fc : La fréquence cardiaque est ralentie, régulière. Il peut exister une légère arythmie respiratoire (quelques apnées)
LA PHASE III DE SOMMEIL LENT PROFOND
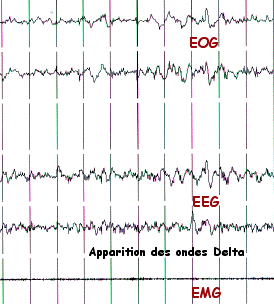
L'activité électrique corticale se ralentit toujours plus et on voit apparaître de grandes ondes lentes et amples de la bande delta (2 à 4 cps), qui occupent moins de 50% du tracé électroencéphalographique. Il persiste une très discrète activité musculaire et les mouvements oculaires ont, quant à eux, complètement disparus. Le coeur et la respiration ont une fréquence stable et particulièrement régulière.
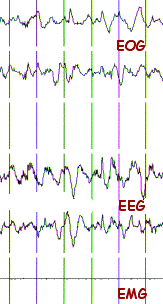
LA PHASE IV DE SOMMEIL LENT PROFOND
dont les tous les paramètres sont identiques à ceux de la phase III, sauf que les activités EEG de type delta occupent plus de 50% du tracé.
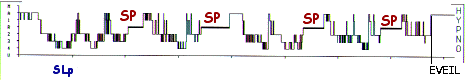
L'HYPNOGRAMME
Un deuxième cycle de sommeil va suivre le premier, qui va durer 90 minutes environ et se terminer par une 2ème phase de sommeil paradoxal de 15 à 20 minutes. Au cours d'une nuit, 4 ou 5 cycles de sommeil et de rêve vont ainsi se succéder, si bien qu'à la fin de la nuit, le sommeil paradoxal représentera environ 20% de la durée totale du sommeil soit environ 100 minutes.
Au fil de la nuit, le sommeil lent est moins profond, les phases IV se faisant moins longues et ayant même tendance à disparaître. Parallèlement, les phases de sommeil paradoxal s'allongent pour être les plus longues au petit matin (5 heures à 7 heures). Notons par ailleurs que les phases de sommeil paradoxal surviennent toujours après un passage plus ou moins long en phase II de sommeil lent, qui est la phase de transition préférentielle avec le sommeil paradoxal.
Les systèmes d'éveil sont disposés en réseaux, l'excitation pharmacologique de l'un étant suivie par l'activation de tous. Cette organisation redondante explique pourquoi l'inactivation d'un seul système est suivie après quelques jours par une récupération complète de l'éveil. Le réseau de l'éveil est activé et entretenu par les stimulations internes (végétatives, émotives) et externes (afférences sensorielles, facteurs socioécologiques). Le réseau exécutif de l'éveil comporte 3 éléments principaux :
L'ÉVEIL
- les neurones thalamiques intra-laminaires (Th I Lamin: système diffus), qui se projettent à l'ensemble du cortex. Ces neurones sont GLU (glutamate) / ASP. (aspartate)
- les neurones cholinergique du système du télencéphale basal(Ch. 4, noyau basal de Meynert - NbM). Il assure à lui seul 70% de l'innervation cholinergique corticale. Il innerve aussi les noyaux thalamiques
- lesneurones histaminergiques de l'hypothalamus postérieur (H POST)
Plusieurs systèmes activateurs des précédents existent dans le tronc cérébral :
- La formation réticulée mésencéphalique (FRM, GLU / ASP) se projette massivement sur les noyaux thalamiques.
- Les noyaux mésopontins cholinergiques (N. MP - Ch. 5 & 6), qui se projettent sur le thalamus. L'acétylcholine a une double action : elle inhibe les neurones pace makers du noyau réticulaire thalamique à l'origine des fuseaux de sommeil (effet muscarinique) et elle active les neurones intra-laminaires thalamo-corticaux (effet nicotinique) et donc, par voie de conséquence, les neurones corticaux. La FRM et les neurones mésopontins cholinergiques forment la voie réticulo-thalamo-corticale.
- Le noyau réticulé bulbaire magnocellulaire (NRB MC) dont les neurones sont cholinergiques ou GLU / ASP se projette sur les noyaux à l'origine de la voie réticulo-thalamo-corticale (FRM et noyaux mésopontins cholinergiques) comme sur le télécenphale basal et l'hypothalamus postérieur. Cet ensemble forme la voie réticulo-hypothalamo-corticale.
- Le noyau locus coeruleus pontique (LC) dont les neurones nor-adrénergiques se projettent sur le thalamus, l'hippocampe et le cortex.
- Les noyaux sérotoninergiques (5-HT) du raphé antérieur (noyau du raphé dorsal - RD - B7), dont les neurones se projettent vers l'hypothalamus et le cortex. Ces neurones présentent des décharges régulières (1-2 Hz), comme une horloge. Ce système, qui innerve l'hypothalamus antérieur au niveau de l'aire préoptique et du noyau suprachiasmatique ( horloge circadienne endogène) parait mesurer la durée et l'intensité de l'éveil, l'éveil pouvant ainsi provoquer sa propre inhibition selon une régulation de type homéostatique : c'est l'éveil qui conduit au sommeil.
-
LE SOMMEIL LENT
L'ENDORMISSEMENT
- Il parait impossible d'obtenir, chez le chat, l'apparition du sommeil lent profond en l'absence de sérotonine. La présence de sérotonine est donc une condition nécessaire et préalable à l'apparition du sommeil lent. Elle agit en inhibant les circuits de l'activation corticale. En effet, il semble exister un système intrahypothalamique, sérotonino-dépendant, participant à la régulation du cycle veille-sommeil. Sallanon et coll. (1990) ont pu démontrer que les neurones de l'hypothalamus postérieur interviennent dans la régulation de l'éveil et que ceux de l'hypothalamus antérieur (H ANT) interviennent dans l'apparition du sommeil lent et du sommeil paradoxal : la sérotonine agirait comme un neuromodulateur sur les neurones de la région préoptique, qui pourraient secondairement bloquer (effets GABAergiques) l'activité d'un relais de l'éveil situé dans l'hypothalamus postérieur. Le sommeil apparait donc lorsque, sous l'influence probable de la sérotonine libérée au cours de l'éveil, la région préoptique (hypothalamus antérieur) et les régions proches du télencéphale basal sont activées. Les neurones de la région préoptique ont une activité maximale pendant le sommeil lent et pratiquement nulle pendant l'éveil et le sommeil paradoxal. Cette activation, par l'intermédiaire d'un facteur encore inconnu (peptidergique ? : VIP ?) va mettre en jeu une cascade d'inhibitions intéressant les systèmes aminergiques éveillants et sera responsable de l'endormissement. Ainsi, c'est l'éveil qui conduit au sommeil.
LE MAINTIEN DU SOMMEIL LENT
Le sommeil lent se caractérise par la disparition de deux conditions majeures, qui accompagnent l'éveil conscient
L'activité corticale se ralentit. Elle est envahie par une activité automatique d'origine thalamique (les fuseaux de sommeil, phase II de sommeil lent léger) et l'on admet que la mise en jeu au cours du sommeil lent de circuits thalamo-corticaux empêchent toute possibilité d'intégration consciente ou de perceptivité. Au fur et à mesure que la profondeur du sommeil augmente apparaissent des ondes lentes de haut voltage (ondes delta) provenant du cortex selon des mécanismes encore mal connus. Les boucles thalamo-corticales, responsables de la synchronisation corticale du sommeil lent, sont libérées lorsque les effets des afférences cholinergiques disparaissent : Effets cholinergiques nicotiniques excitateurs directs (nACh) sur les cellules pyramidales et les neurones thalamo-corticaux des noyaux intra-laminaires - Effets cholinergiques muscariniques inhibiteurs (mACh) des neurones pace-maker GABAergiques du noyau réticulaire thalamique La disparition de ces effets cholinergiques libèrent les neurones pace-maker du noyau réticulaire thalamique (Th. Réticul.- GABA), qui peuvent alors entrainer, à leur rythme, les neurones thalamo-corticaux et donc les cellules pyramidales du cortex (fuseaux de sommeil).
Le sommeil s'accompagne également d'une diminution de l'activité du système bulbaire sympatho-excitateur adrénergique(C1 - nPGCl), ce qui provoque une vasodilatation périphérique (avec une diminution de la tension artérielle) et donc une perte de chaleur (avec une diminution de la température corporelle et cérébrale), une diminution du métabolisme basal (i. e. d'une diminution de la demande énergétique globale) et une diminution marquée de la consommation de glucose et d'oxygène par le cortex cérébral. Les réserves énergétiques sont stockées dans les cellules gliales, cellules nutritives des neurones, sous forme de glycogène. Cette diminution d'activité du système bulbaire sympatho-excitateur peut également entrainer une absence d'excitation des neurones SP-off Tout ceci fait du sommeil lent une phase préparatoire du sommeil paradoxal.
LES PARASOMNIESLes rythmies surviennent à la transition veille-sommeil.
Il peut s'agir de mouvements de la tête d'avant en arrière ou de mouvements latéraux de droite à gauche voire même de mouvements de balancement du tronc ou de tout le corps d'avant en arrière, quand l'enfant est sur les genoux ou à quatre pattes. Ces rythmies débutent vers l'âge de 6 à 9 mois et toujours avant 18 mois; elles s'observent chez le garçon dans 70 à 80% des cas. Ces rythmies ont une intensité variable mais quand les mouvements sont violents, les heurts de la tête peuvent entraîner des bosses ... Elles débutent avant l'endormissement et se poursuivent en sommeil lent léger. Elles surviennent, le plus souvent, chez un enfant au développement psychomoteur normal; leur déclenchement est alors parfois favorisé par une affection intercurrente ou des facteurs psychologiques. Habituellement, les rythmies disparaissent spontanément vers l'âge de 4 ans. Leur persistance chez l'enfant normal devra faire pratiquer un bilan psychologique. Aucun traitement n'est habituellement nécessaire mais il est parfois cependant recommandé de prendre des mesures pour éviter les chocs (rembourrage du lit, matelas sur le sol....) et éviter le bruit souvent angoissant pour les parents généré par les mouvements rythmiques. Chez l'enfant plus âgé et dans les formes intenses, il faut rechercher des problèmes d'ordre affectif et lutter contre l'anxiété. Il est rare que l'on soit amené à prescrire un anxiolytique ou un antidépresseur.
Somnambulisme et terreurs nocturnes surviennent à la fin du sommeil lent profond du 1er ou du 2ème cycle de sommeil - au moment du passage vers le sommeil paradoxal.
Le somnambulisme s'observe surtout chez le garçon de 7 à 12 ans, de façon occasionnelle chez 15 à 45% des enfants. Habituellement 2 à 3 heures après l'endormissement, l'enfant sort de son lit, marche dans sa chambre, dans la maison, voire à l'extérieur. Il a les yeux ouverts, le regard vide, effectue des activités habituelles ou parfois insolites. L'adulte peut le reconduire doucement dans son lit tant qu'il n'essaie pas de le réveiller, ce qui est d'ailleurs totalement inutile. L'enfant n'en gardera aucun souvenir. La durée de l'accès peut varier de quelques minutes à une demi- heure. Ces accès de somnambulisme disparaissent vers la puberté.
La terreur nocturne serait observée chez 1 à 6% des enfants d'âge scolaire. Elle débute souvent entre l'âge de 3 à 6 ans et survient surtout chez le petit garçon, au cours des 3 premières heures de la nuit. L'enfant crie, s'assoit dans son lit, hurle, a les yeux ouverts et fixes. Il peut tenir des propos incohérents et gesticuler. Des phénomènes neuro-végétatifs sont toujours présents : sueurs, pâleur ou rougeur du visage, tachycardie, tachypnée. Lorsque l'on essaie de toucher ou de calmer l'enfant, celui-ci devient encore plus agité, peut se débattre et avoir un "réflexe d'échappement", il se lève et déambule violemment. L'épisode est habituellement unique, dure 1 à 20 minutes et l'enfant se rendort spontanément. Ce trouble disparaît également à la puberté.
Les cauchemars sont des rêves effrayants qui réveillent l'enfant, le laissent angoissé et apeuré et qui surviendraient de façon occasionnelle chez 30% des enfants de 5 ans; ils augmentent de fréquence avec l'âge et sont plus fréquents chez les filles. Le cauchemar survient donc, quel que soit l'âge, en deuxième partie de nuit; il s'accompagne d'un éveil où l'enfant retrouve rapidement une conscience normale et peut raconter ce « mauvais rêve». Ces caractéristiques essentielles permettent de différencier les cauchemars des terreurs nocturnes. Les cauchemars sont favorisés par le stress ou par des facteurs physiques (fièvre ...) Ils accompagnent le développement psychologique normal et les expériences de vie de l'enfant (angoisse de séparation, rivalité fraternelle, pulsions...) Le traitement est d'attention, de douceur, d'explication, dès que l'enfant peut comprendre ce qu'est un rêve. Certains cas particuliers, comme les cauchemars post- traumatiques survenant chez des enfants victimes d'accident grave ou d'attentat... nécessitent une prise en charge psychologique spécifique et parfois prolongée.
L'énurésie nocturne primaire désigne des mictions involontaires pendant la nuit par un enfant assez vieux pour être propre. L'énurésie est dite primaire lorsque l'enfant n'a jamais contrôlé sa vessie, et secondaire lorsqu'elle survient après au moins six mois de propreté. Les enfants ne devraient pas être qualifiés d'énurétiques à moins qu'ils ne mouillent régulièrement leur lit (plus de deux fois par semaine) après l'âge de 5 ans pour les filles et de 6 ans pour les garçons. L'énurésie nocturne primaire est plus fréquente chez les garçons. On la constate chez 10 % à 15 % des enfants de 5 ans, chez 6 % à 8 % de ceux de 8 ans, et elle chute à 1 % à 2 % à 15ans. L'énurésie nocturne primaire devrait être perçue comme une variante du développement du contrôle normal de la vessie. Il importe de rassurer l'enfant, de le soutenir et d'éviter de le punir ou de l'humilier pour qu'il conserve son estime de soi ainsi que de réduire au minimum la frustration des parents. L'énurésie qui persiste après l'âge de huit à dix ans peut s'associer à une mauvaise image de soi-même ou à d'autres problèmes d'ordre psychologique.
L'hypersomnie
- CONSEQUENCES SOCIO-PROFESSIONNELLES
Les conséquences socio-professionnelles et familiales des hypersomnies (narcolepsie - hypersomnie idiopathique) sont importantes. La maladie entraîne :
- des changements fréquents d'emplois souvent suivis par un chômage de longue durée
- une désintégration de la cellule familiale (divorces fréquents)
- ces bouleversements socio-professionnels et familiaux finissant par retentir sur la personnalité des patients - avec survenue de troubles névrotiques ou dépressifs qui compliquent la prise en charge thérapeutique.
LE SYNDROME D'APNÉES OBSTRUCTIVES DU SOMMEIL (SAOS)
L'individualisation du syndrome d'apnées obstructives du sommeil (SAOS) est relativement récente puisqu'elle remonte en 1976. Il reste que l'existence de troubles respiratoires nocturnes est connue depuis l'Antiquité et que Charles Dickens nous a laissé une description remarquable du tableau clinique, que le corps médical dénommera bien plus tard le " syndrome de Pickwick ". Les études épidémiologiques indiquent clairement qu'il s'agit d'une pathologie fréquente touchant 2 à 4% de la population adulte. Dans les centres d'études du sommeil, ce syndrome d'apnées est à l'origine de 43 à 59% des consultations pour hypersomnolence diurne et de 6 à 29% des consultations pour insomnie chronique. Encore insuffisamment reconnu, le SAOS se caractérise par la survenue répétitive d'apnées obstructives et d'hypopnées au cours du sommeil. La survenue de ces événements respiratoires nocturnes induit une importante désorganisation de la macrostructure comme de la micro architecture du sommeil. De part le retentissement sur la vigilance diurne de ces troubles du sommeil, le SAOS a un net impact sur la qualité de vie des patients. Tant les conséquences socioprofessionnelles des troubles de la vigilance que les fréquentes complications cardio- et cérébro-vasculaires du SAOS en font un véritable problème de santé publique.
DEFINITION
Le SAOS se définit par la survenue répétitive, au cours du sommeil, d'obstructions complètes ou partielles des voies aériennes supérieures, responsables d'apnées ou d'hypopnées
- Une apnée est définie par l'arrêt du flux aérien durant plus de 10 secondes, cet arrêt pouvant être d'origine centrale (absence de commande respiratoire), obstructive (obstruction des voies aériennes supérieures avec persistance des efforts ventilatoires) ou mixte (c'est à dire d'origine centrale puis obstructive). Au cours des apnées obstructives, la contraction des muscles respiratoires est incapable de faire entrer l'air dans les poumons du fait de l'obstruction des voies aériennes supérieures. Les apnées peuvent s'accompagner de micro éveils.
- Il n'existe aucun consensus sur la définition des hypopnées. La recherche de la survenue d'hypopnées suppose une mesure quantitative, et non plus seulement qualitative, de la ventilation. A ce jour, la définition la plus utilisée est une diminution de la ventilation (du flux aérien) d'au moins 50 % pendant au moins 10 secondes, diminution associée à une désaturation artérielle en oxygène d'au moins 4%. Les hypopnées peuvent aussi s'accompagner de micro éveils.
- On calcule alors un index d'apnées-hypopnées, soit le nombre d'apnées et d'hypopnées par heure de sommeil :
En fait, une valeur d'IAH n'a de sens que si elle est associée à des signes cliniques. La sévérité d'un SAOS ne peut se réduire à un index mais doit tenir compte de l'invalidité que représente l'hypersomnolence, de la souffrance physique et relationnelle des patients, des répercussions du syndrome sur le système cardio-respiratoire et sur le système nerveux.IAH = (Nombre d'apnées + Nombre d'hypopnées) / Durée du Sommeil (mn) x 60
PHYSIOPATHOLOGIE DU SAOS
Le SAOS est caractérisé par la répétition d'occlusions complètes (apnées) ou incomplètes (hypopnées) du pharynx. Cette région anatomique est complexe et est constituée de parois comportant des muqueuses, des muscles et des aponévroses. On remarque que le pharynx n'est constitué d'aucune structure rigide pour les soutenir et offre donc une grande susceptibilité à la déformation. Une anomalie des voies aériennes ou des muscles respiratoires peut n'entraîner aucun trouble pendant le jour grâce à des systèmes compensateurs, dont la perte pendant le sommeil peut favoriser l'apparition d'apnées.
- CALIBRE ET FORME DES VOIES AÉRIENNES SUPÉRIEURES
A l'éveil, la forme des voies aériennes supérieures (VAS) est différente entre les sujets non ronfleurs, ronfleurs non apnéiques et apnéiques. L'augmentation de l'épaisseur des parois pharyngées latérales, des dépôts graisseux le long des parois pharyngées induisent une compression latérale des VAS. Toutes les anomalies morphologiques des VAS, comme une micrognathie, une rétrognathie, une hypertrophie de la base de la langue, favorisent et sont fréquemment associées à un SAOS. Il existe, en outre, une inflammation de la muqueuse des VAS chez les sujets apnéiques. Cette inflammation joue sur la collapsibilité des VAS par le biais d'une diminution de leur calibre lorsque le tonus vasculaire augmente. Des signes de souffrance musculaire à type de fibrose et d'dème ont également été décrits dans certains muscles des VAS. Ces anomalies sont de plus en plus marquées en fonction de l'importance des troubles respiratoires au cours du sommeil. De fait, elles témoignent des conséquences du traumatisme des VAS lié à la vibration tissulaire nocturne. Ces modifications tissulaires jouent elles-mêmes un rôle dans les propriétés mécaniques des tissus des VAS. L'élastance de la luette, reflet de la rigidité tissulaire, est plus élevée chez les patients apnéiques que chez les ronfleurs et ce, par dème, inflammation et fibrose des tissus péri musculaires associés à une plus grande proportion de tissu adipeux. Ainsi, l'index d'apnée augmente proportionnellement à l'élastance de la luette et, malgré une plus grande capacité à générer une tension des muscles dilatateurs des VAS chez le sujet apnéique (cf. infra), le déplacement tissulaire est moindre du fait d'une inefficacité de transmission de cette force dilatatrice aux tissus mous.
- LES MUSCLES DILATATEURS DES VOIES AÉRIENNES SUPÉRIEURES
La contraction des muscles inspiratoires (essentiellement du diaphragme) crée une dépression négative, c'est à dire inférieure à la pression atmosphérique, ce qui attire l'air dans les poumons. Cette pression négative a tendance à fermer le conduit des VAS. Normalement, un mécanisme protecteur est mis en jeu avant même le début de l'inspiration par la contraction des muscles dilatateurs du pharynx. L'activité électromyographique phasique des muscles dilatateurs précède celle des muscles respiratoires. En outre, l'activité tonique des muscles oropharyngés est un élément important du maintien de la perméabilité des VAS, une diminution de cette activité tonique s'accompagnant d'une diminution de volume des VAS. En fait, toute modification de l'activité des muscles dilatateurs du pharynx va modifier la collapsibilité des VAS. Ainsi, les activités toniques et phasiques des muscles des VAS diminuent avec le sommeil, de façon variable d'un muscle à l'autre. Outre le sommeil, les muscles dilatateurs sont sensibles aux stimuli métaboliques (hypoxie, hypercapnie) et mécaniques (pression négative dans les VAS). Il faut noter à ce propos les effets délétères de l'alcool et de certains médicaments comme les benzodiazépines qui dépriment l'activité des muscles pharyngés. Mais, il apparaît, en fait, que l'activité du muscle génioglosse est plus élevée chez les patients apnéiques que chez les sujets normaux à l'endormissement, au cours du sommeil mais surtout à l'éveil. Les caractéristiques histochimiques et métaboliques des fibres musculaires des muscles pharyngés et laryngés varient entre les sujets apnéiques et ronfleurs simples, l'ensemble des muscles pharyngés et laryngés des sujets ronfleurs et apnéiques semblant faire face à une adaptation physiologique en réponse à un exercice de type résistif répété supra maximal prolongé : hypertrophie musculaire - augmentation de la proportion des fibres IIA à contraction rapide – augmentation des activités enzymatiques de la voie anaérobique ... On ne peut donc pas invoquer une simple diminution de l'activité des muscles dilatateurs oropharyngés dans le sommeil pour expliquer l'obstruction des VAS dans le SAOS.
- IRRÉGULARITÉS RESPIRATOIRES DANS LE SOMMEIL ET DÉCLENCHEMENT DES APNÉES
Plusieurs arguments supportent actuellement l'hypothèse que les irrégularités respiratoires, telles que l'alternance d'hypo et d'hyperventilations, sont en fait à l'origine des apnées obstructives :
- Celles-ci sont presque exclusivement observées dans le sommeil lent léger et au cours du sommeil paradoxal, où il existe des fluctuations physiologiques de la ventilation mais pratiquement jamais au cours du sommeil lent profond, où la respiration est très stable et régulière.
- La respiration au cours du sommeil reste périodique après trachéotomie chez les patients porteurs d'un SAOS
- L'induction de phénomènes de respiration périodique dans le sommeil s'accompagne d'obstructions des VAS chez l'homme normal ...
Il existe, de fait, au cours des périodes d'hypoventilation, une baisse de l'activité des muscles oropharyngés comme un retard d'activation de ces muscles par rapport aux muscles respiratoires – retard de contraction des muscles dilatateurs observé dans la majorité des apnées obstructives. L'origine d'une telle instabilité respiratoire chez le patient apnéique reste à élucider, l'augmentation des résistances des VAS pouvant elle-même induire une instabilité respiratoire.
EPIDEMIOLOGIE DU SYNDROME D'APNÉES DU SOMMEIL
Dans la plupart des études récentes se basant sur un IAH > 15 dans des groupes d'âge moyen, la prévalence du SAOS est comprise entre 4 et 25%. Cependant, la fréquence réelle du SAOS n'est pas connue avec certitude car aucun échantillon représentatif de la population générale n'a bénéficié d'une polysomnographie de dépistage
FACTEURS JOUANT SUR LA PRÉVALENCE DU SAOS
La prévalence du SAOS augmente nettement avec l'âge et ce, surtout après 60 ans.
Dès les premières études, il est apparue une nette prédominance masculine. Le rôle des hormones sexuelles est confirmée par l'augmentation de la prévalence des troubles respiratoires nocturnes chez la femme après la ménopause. L'administration d'hormones mâles provoque l'aggravation d'un SAOS chez l'homme et l'apparition d'un SAOS chez la femme.
La grande fréquence des obèses parmi les patients atteints de SAOS est une notion classique. Le rôle de l'obésité, essentiellement l'obésité tronculaire (ou androïde), est confirmé par la diminution de l'IAH après une perte de poids.
Il existe également une association nette entre SAOS et ronflements.
En concordance avec une association tabagisme ronflements, on retrouve une proportion significativement plus élevée de SAOS chez les fumeurs. Après ajustement sur l'âge, le poids, la consommation de café et d'alcool, le risque relatif est 3 fois plus élevé chez les fumeurs.
Il existe une prévalence très élevée des anomalies ORL chez les patients atteints de SAOS - surtout l'obstruction nasale
Certaines études arguent en faveur de l'existence d'un facteur génétique, trouvant une prévalence exceptionnellement élevée (47%) de troubles respiratoires nocturnes chez les fils de 45 patients présentant un SAOS. Des familles présentant plusieurs patients atteints d'un SAS ont été décrites dans la littérature. Cette ségrégation familiale s'explique par le fait que la plupart des facteurs de risques impliqués dans la physiopathologie des SAS sont largement déterminés génétiquement (obésité, alcoolisme, facteurs anatomiques osseux et des tissus mous qui prédisposent à l'obstruction des voies aériennes supérieures).
Des différences de configuration anatomique des voies aériennes supérieures laissent supposer une influence ethnique sur la survenue d'un SAOS. Il existe un risque 2 fois plus important de troubles respiratoires nocturnes chez les Américains d'origine africaine comparativement aux Américains d'origine caucasienne. Les sujets d'origine africaine présentent des troubles respiratoires nocturnes en moyenne 8,4 ans plus tôt que les patients d'origine caucasienne.
Certaines pathologies endocrines, enfin, sont fréquemment associées à un SAOS, comme l'acromégalie, le syndrome de Cushing ou, surtout, une hypothyroïdie et un diabète.
L'administration de certains médicaments comme les benzodiazépines(somnifères, anxiolytiques ..) et les bêtabloquants aggravent un SAOS.
SAOS, MORBIDITÉ ET MORTALITÉ
Au plan de la morbidité, les risques relatifs comparés à des sujets normaux de même âge sont de 2 fois plus d'hypertension artérielle (HTA), 3 fois plus d'insuffisance coronarienne et 4 fois plus d'accidents vasculaires cérébraux
L'influence du SAOS seul sur la mortalité reste cependant controversée et d'une grande actualité. Une première étude portant sur 20 sujets âgés ne constate aucune différence due à la présence d'événements respiratoires nocturnes dans les taux de morbidité et de mortalité. A l'opposé, d'autres auteurs trouvent, sur 385 sujets masculins suivis pendant 8 ans, une probabilité de survie cumulée nettement diminuée chez les patients ayant un IA > 20 (0,63) comparativement à celle (0,96) des patients avec un IA < 20 et ce, surtout pour les sujets âgés de moins de 50 ans. Une étude rapporte une mortalité triple chez les sujets âgés avec un IA > 10. Une étude récente portant sur 1620 patients avec SAOS montre un excès de mortalité pour les hommes de 40 à 60 ans et souligne le rôle délétère de l'obésité et de l'hypertension. Une étude rétrospective portant sur 3 100 hommes âgés de 30 à 69 ans a étudié la mortalité associée au ronflement et à la somnolence diurne excessive sur une période de 10 ans : une augmentation de mortalité (RR = 2,7) a été retrouvée chez les sujets de moins de 60 ans souffrant de ronchopathie et d'hypersomnolence diurne.
SAOS ET QUALITÉ DE VIE - SAOS ET SANTÉ PUBLIQUE
L'hypoxémie nocturne due à la survenue répétitive des apnées a des conséquences à long terme (HTA, polyglobulie, vieillissement cérébral). Les nombreux micro éveils nocturnes induits par les apnées, si ils sont au départ " protecteurs ", entraînent une importante fragmentation du sommeil elle-même à l'origine de profonds troubles de la vigilance diurne. Apparaissent des troubles de l'attention et de la mémoire, une irritabilité, une certaine morosité voire un syndrome dépressif avec une détérioration des rapports familiaux et professionnels. Au plan social, les conséquences les plus graves de cette hypersomnolence diurne restent la survenue d'endormissements au volant produisant des accidents de la circulation. Aujourd'hui, les pathologies du sommeil et les troubles de la vigilance sont inscrites parmi les affections susceptibles de donner lieu à la délivrance d'un permis de conduire de durée de validité limitée (Journal Officiel du 29 Mai 1997Il existe, de fait, une augmentation de la consommation des ressources de santé chez les patients porteurs d'un SAOS. En outre, ces patients représentent un danger tant sur les routes que sur leur lieu de travail, majoré par le fait que tant les malades que le corps médical négligent le syndrome. Pour les pouvoirs publics, le SAOS pose des problèmes de coût : coût du diagnostic – essentiellement de la polysomnographie, coût du traitement à long terme - essentiellement de la pression positive continue (PPC). On peut espérer qu'un diagnostic précoce et un traitement efficace préviendront la survenue des complications et que l'on parviendra à trouver des procédures diagnostiques plus simples et moins coûteuses. - CONSEQUENCES SOCIO-PROFESSIONNELLES
- ASPECTS CLINIQUES DU SYNDROME D'APNÉES DU SOMMEIL
- Les patients atteints de SAOS se présentent rarement d'emblée chez le spécialiste du sommeil. La myriade de symptômes présentés, peu spécifiques du SAOS, amène la consultation d'un grand nombre de spécialistes divers. Le tableau ci-dessous énumère la liste des symptômes rencontrés.
- SYMPTOMES RENCONTRÉS DANS UN SAOS
- SIGNES DIURNES
Céphalées matinales
Hypersomnolence
Troubles de la mémoire
Accès de sommeil non réparateurs
Difficultés de concentration
Troubles du comportement
Syndrome dépressif
Troubles de la libido - Impuissance
Comportements automatiques
Accidents de la circulation, accidents professionnels
RL'oto-rhino-laryngologiste est consulté pour des ronflements; l'endocrinologue voit s'endormir dans sa salle d'attente un patient obèse vraisemblablement affecté par un SAOS; le médecin du travail peut être alerté par un conducteur s'endormant fréquemment au volant de sa voiture, de son camion ou de son train; les troubles de la libido amènent le patient dans le cabinet de l'urologue; le psychiatre peut être consulté pour des pertes de mémoire, des troubles de l'humeur voire un syndrome dépressif; les pneumologues et les cardiologues peuvent voir le patient au stade de l'insuffisance respiratoire ou de la décompensation cardiaque droite; les neurochirurgiens sont confrontés à la survenue brutale d'un accident vasculaire cérébral. Les praticiens voient un adulte fatigué, généralement accompagné de son partenaire tout aussi las à cause des ronflements incessants et sonores de son conjoint et souvent angoissé par les multiples apnées nocturnes qu'il peut observer.onflements
SI
- Le poids et la taille sont des éléments essentiels du dossier. Ils permettent le calcul de l'index de masse corporelle (IMC). L'obésité est retrouvée chez environ deux tiers des patients porteurs d'un SAOS (IAH > 20 – 62% des patients ont un IMC > 30 kg/m2). Il s'ensuit que plus d'un tiers des patients ne sont pas obèses, environ 9% d'entre eux pouvant avoir un poids normal (IMC < 25). Une obésité franche (IMC > 35 kg/m2) est présente dans environ 25% des cas. Il faut souligner à ce propos qu'une obésité marquée est beaucoup plus fréquente dans les séries nord-américaines et australiennes que dans les séries européennes (IMC moyen : 31-33 kg/m2).
- L'hypertension artérielle est retrouvée chez 50% des patients avec SAOS et la prévalence du SAOS au sein d'un groupe de sujets hypertendus est au moins 3 fois plus importante que celle de sujets normotendus. Si l'on stratifie précisément les données en fonction de l'index de masse corporelle, il existe une relation significative entre l'IAH et la pression artérielle et ce, surtout chez les sujets de moins de 50 ans.
- SIGNES NOCTURNES
GLE
L'HYPERSOMNOLENCE DIURNE
La déstructuration du sommeil liée à la fréquence des micro éveils et à la quasi absence de sommeil lent profond provoque une hypersomnolence diurne, qui peut prendre des degrés très divers. Elle va se manifester d'abord en période postprandiale puis survenir dès que le patient n'est plus stimulé (lecture, tâches répétitives, conduite monotone) pour devenir majeure, compromettant la vie familiale, sociale et professionnelle du patien. Évaluée par des échelles de somnolence comme la très classique échelle d'Epworth, elle peut être sous-estimée par le patient car elle fait partie de son quotidien depuis des mois voire des années. 40% des patients ayant un score à l'échelle d'Epworth inférieur à 12, et donc sans hypersomnolence diurne excessive, ont un IAH supérieur à 20. En outre, il ne faut pas négliger les patients qui n'ont aucun intérêt à se plaindre de leur somnolence comme les chauffeurs routiers ou les conducteurs de train et ce, de peur de perdre leur emploi. La survenue d'endormissements chez les conducteurs automobiles est cependant une des conséquences les plus graves du SAOS en raison du risque d'accidents 2 à 3 fois supérieur à celui de la population générale, risque qui augmente avec la gravité du SAOS. Il est par ailleurs intéressant de noter qu'il n'existe pas de liens de proportionnalité entre la somnolence diurne évaluée par l'échelle d'Epworth ou objectivée au laboratoire par un test itératif de latence d'endormissement, d'une part, et les différents paramètres polysomnographiques témoignant de la sévérité du SAOS (IAH, micro éveils .. ), d'autre part.S RONFLEMENTS
Le ron
AUTRES MANIFESTATIONS DIURNES
Nettement moins évocatrices, ces manifestations sont cependant importantes à connaître et à rechercher. On observe :
- Des céphalées matinales ou qui réveillent le patient. Elles peuvent persister plusieurs heures après le réveil et survenir après une sieste prolongée.
- Des troubles de la libido, en particulier chez l'homme – touchant jusqu'à 28% des patients
- La somnolence diurne peut interférer avec les fonctions intellectuelles. On ne sait si l'altération des fonctions supérieures (défaut de concentration et de l'attention, altération de la mémoire et du contrôle visuo-moteur) est liée à la somnolence ou à la pathologie respiratoire dans le sommeil et à l'hypoxémie.
- Des troubles de l'humeur et du comportement, avec irritabilité et même dépression, dont on ne sait également s'ils sont dus aux troubles du sommeil ou à la pathologie respiratoire dans le sommeil. flement est un symptôme cardinal, existant chez 70 à 95% des patients présentant un SAOS. Il s'agit d'un bruit intense, entrecoupé de gargouillements, allant crescendo pour être interrompu par une apnée et réapparaître de façon explosive à la reprise ventilatoire. Souvent source de conflits conjugaux de part sa sonorité qui empêche le partenaire de chambre de dormir, il est provoqué par la mise e
VALEUR PRÉDICTIVE DES SIGNES CLINIQUES
Plusieurs études ont tenté d'évaluer la valeur prédictive de l'anamnèse et d'un examen clinique simple chez les patients suspects de SAOS. Certains, en associant les variables âge, apnées observées p
ar le conjoint, IMC et HTA, ont développé une formule de prédiction diagnostique dont la sensibilité est de 92% mais dont la spécificité n'est que de 51% et ce, pour un seuil d'IAH fixé à 15. De même, sur l'étude de 215 patients suspects de SAOS, d'autres auteurs montrent qu'aucune variable prise isolément n'est utile pour prédire un SAOS; cependant, la combinaison du sexe, de l'âge, de la fréquence du ronflement, des apnées observées par le partenaire, l'existence d'une somnolence diurne, la consommation d'alcool et, enfin, l'IMC permet d'exclure le SAOS, avec un IAH égal à 15, mais pas de l'affirmer.Plusieurs études ont tenté d'évaluer la valeur prédictive de l'anamnèse et d'un examen clinique simple chez les patients suspects de SAOS. Certains, en associant les variables âge, apnées observées par le conjoint, IMC et HTA, ont développé une formule de prédiction diagnostique dont la sensibilité est de 92% mais dont la spécificité n'est que de 51% et ce, pour un seuil d'IAH fixé à 15. De même, sur l'étude de 215 patients suspects de SAOS, d'autres auteurs montrent qu'aucune variable prise isolément n'est utile pour prédire un SAOS; cependant, la combinaison du sexe, de l'âge, de la fréquence du ronflement, des apnées observées par le partenaire, l'existence d'une somnolence diurne, la consommation d'alcool et, enfin, l'IMC permet d'exclure le SAOS, avec un IAH égal à 15, mais pas de l'affirmer.n vibration des parties molles du pharynx comprenant la luette, le voile du palais et la base de la langue, mise en vibration secondaire aux turbulences du flux aérien inspiratoire. Il faut savoir qu'il Plusieurs études ont tenté d'évaluer la valeur prédictive de l'anamnèse et d'un examen clinique simple chez les patients suspects de SAOS. Certains, en associant les variables âge, apnées observées par le conjoint, IMC et HTA, ont développé une formule de prédiction diagnostique dont la sensibilité est de 92% mais dont la spécificité n'est que de 51% et ce, pour un seuil d'IAH fixé à 15. De même, sur l'étude de 215 patients suspects de SAOS, d'autres auteurs montrent qu'aucune variable prise isolément n'est utile pour prédire un SAOS; cependant, la combinaison du sexe, de l'âge, de la fréquence du ronflement, des apnées observées par le partenaire, l'existence d'une somnolence diurne, la consommation d'alcool et, enfin, l'IMC permet d'exclure le SAOS, avec un IAH égal à 15, mais pas de l'affirmer.existe des SAOS " silencieux " qui sont soit des SAOS extrêmement sévères s'accompagnant d'une insuffisance respiratoire ne permettant plus de générer les pressions et les débits suffisants pour produire le ronflement soit des SAOS continuant à se développer à bas bruit chez les patients ayant déjà bénéficié d'une uvulo-palato-pharyngoplastie.Plusieurs études ont tenté d'évaluer la valeur prédictive de l'anamnèse et d'un examen clinique simple chez les patients suspects de SAOS. Certains, en associant les variables âge, apnées observées par le conjoint, IMC et HTA, ont développé une formule de prédiction diagnostique dont la sensibilité est de 92% mais dont la spécificité n'est que de 51% et ce, pour un seuil d'IAH fixé à 15. De même, sur l'étude de 215 patients suspects de SAOS, d'autres auteurs montrent qu'aucune variable prise isolément n'est utile pour prédire un SAOS; cependant, la combinaison du sexe, de l'âge, de la fréquence du ronflement, des apnées observées par le partenaire, l'existence d'une somnolence diurne, la consommation d'alcool et, enfin, l'IMC permet d'exclure le SAOS, avec un IAH égal à 15, mais pas de l'affirmer. Ainsi, si la prédiction diagnostique des ces diverses équations est supérieure à la simple impression du clinicien, aucune n'est suffisamment spécifique pour remplacer la polysomnographie en cas de suspicion de SAOS. A l'opposé, chez les sujets classés comme ayant une faible probabilité clinique de SAOS (10 à 30% des patients selon les études), la sensibilité de ces approches pourrait être suffisante pour exclure le diagnostic et éviter ainsi environ 30% des polysomnographies inutiles. La généralisation de ces formules à tous les laboratoires de sommeil est cependant difficile car les résultats dépendent de la prévalence du SAOS dans la population étudiée, prévalence variable selon le recrutement propre de chaque laboratoire.
Rappelons que les différentes études épidémiologiques réalisées chez les patients porteurs d'un SAOS retrouvent une surmortalité liée à l'IAH, l'âge du patient, son poids ou la présence d'une HTA concomitante. L'existence d'un SAOS augmente le risque de voir survenir une hypertension artérielle systémique (HTA), des troubles nocturnes du rythme cardiaque, un infarctus du myocarde, une insuffisance cardiaque et une ischémie cérébrale. - Le SAOS entraîne une importante fragmentation du sommeil. En effet, chaque reprise ventilatoire au décours d'une apnée nécessite un allègement du sommeil ou la survenue d'un micro éveil, causes d'une désorganisation majeure du sommeil. L'index d'efficacité du sommeil est nettement diminué, avec une augmentation de l'éveil intra-sommeil aux dépens de la durée totale du sommeil. Le sommeil en lui-même s'approfondit peu, avec une nette augmentation du sommeil lent léger (Stades I et II) aux dépens du sommeil lent profond (Stades III et IV). Le sommeil paradoxal est quant à lui également diminué.
- De nombreuses modifications cardio-vasculaires aiguës, liées aux apnées et aux hypopnées, surviennent dans le sommeil. Ces modifications hémodynamiques propres au SAOS viennent se surajouter aux changements hémodynamiques spécifiques à chaque état de vigilance.
- On rapporte également des modifications endocriniennes, liées tant à la survenue des événements respiratoires nocturnes qu'à l'importante fragmentation du sommeil qui en découle. On observe, en effet, chez les patients porteurs d'un SAOS sévère, une augmentation de la diurèse et de la natriurèse nocturnes. Ceci est dû à une augmentation de la sécrétion du facteur atrial natriurétique. On note également un déficit de sécrétion en hormone de croissance, lié à la disparition du stade IV de sommeil lent profond, stade au cours duquel on observe normalement le pic de sécrétion de cette hormone.
RETENTISSEMENTS IMMÉDIATS- Au cours du sommeil lent, on observe une chute progressive physiologique de la fréquence cardiaque, du débit cardiaque et de la pression artérielle. La chute du débit cardiaque est liée à la réduction relative de la fréquence cardiaque, sans modification du volume d'éjection systolique. La chute de la pression artérielle est liée à la chute du débit cardiaque, sans modification des résistances vasculaires périphériques. Ces modifications sont les plus marquées au cours du stade IV de sommeil lent profond et sont essentiellement liées à une augmentation du tonus vagal parasympathique au cours du sommeil lent. Au cours du sommeil paradoxal, il existe, à l'opposé, une grande variabilité du rythme cardiaque et de la pression artérielle liée à une augmentation du tonus orthosympathique.
- Les patients atteints d'un SAOS vont présenter, au cours de la nuit, des oscillations permanentes de leurs paramètres hémodynamiques (fréquence cardiaque, débit cardiaque, pression artérielle). Ces oscillations sont liées tant à la survenue des événements respiratoires nocturnes qu'aux changements rapides d'états de vigilance (micro éveils) induits par ces anomalies ventilatoires. Elles sont donc le résultat de l'intégration des réponses à 5 types de stimuli : l'hypoxie, l'hypercapnie, les modifications de volume pulmonaire ou de pression endothoracique, les micro éveils liés aux apnées comme le stade de vigilance au cours duquel survient l'apnée. Si la bradycardie en cours d'apnées continue à être décrite comme une manifestation classique du SAOS, la tendance actuelle penche pour une accélération de la fréquence cardiaque en cours d'apnée avec une augmentation supplémentaire lors du micro éveil et de la reprise ventilatoire. Seuls 10% des patients, porteurs de SAOS majeur et très désaturant, présenteraient des bradycardies très sévères de fin d'apnée. La chute habituelle de la pression artérielle observée au cours de la nuit chez le sujet normal disparaît chez le patient apnéique et ce d'autant plus que le SAOS est plus sévère. La pression artérielle atteint son niveau le plus bas au début de l'apnée puis va crescendo pour atteindre son niveau maximum quelques secondes après la reprise ventilatoire au moment du micro éveil – moment où la SaO2 est minimale.
- La vitesse du flux sanguin cérébral (VFSC) varie parallèlement à la pression artérielle. Pression artérielle et VFSC augmentent donc au cours de l'apnée pour atteindre un maximum au moment de la reprise ventilatoire. Il existe alors une chute rapide de la pression artérielle et de la VFSC, qui devient inférieure aux valeurs initiales. Avec la répétition des apnées, on peut donc observer des périodes prolongées de diminution du débit sanguin cérébral. Cette diminution du débit sanguin cérébral est liée à la longueur des événements obstructifs et à la désaturation associée. La période d'hypotension suivant immédiatement la reprise ventilatoire pendant laquelle l'hypoxémie est importante et la perfusion cérébrale minimum correspond probablement au moment où le cerveau est le plus vulnérable – tendant à expliquer le risque accru d'accidents vasculaires cérébraux chez les patients apnéiques.
RETENTISSEMENTS A LONG TERME
INSUFFISANCE RESPIRATOIRE CHRONIQUE
On sait depuis que l'on explore sur une grande échelle les malades présentant un SAOS que la plupart d'entre eux n'ont pas d'insuffisance respiratoire, définie par des troubles gazométriques diurnes ni même par un déficit ventilatoire appréciable. Dans le cadre du SAOS, il convient, en fait, de parler d'insuffisance respiratoire avec hypoxémie (PaO2 < 70 mm Hg) – hypercapnie (PaCO2 > 45 mm Hg) puisqu'une obésité isolée importante peut induire une hypoxémie sans qu'il y ait d'insuffisance respiratoire au sens strict; l'hypoxémie isolée peu importante est donc banale chez les patients SAOS obèses. Sur 265 patients SAOS, la survenue d'une hypoxémie, définie par une PaO2 < 65 mm Hg, n'est présente que dans 27% des cas, la fréquence de l'hypercapnie n'étant que de 10%. L'hypoventilation alvéolaire chronique étant la cause principale de l'hypertension artérielle pulmonaire (HTAP) dans les affections respiratoires chroniques, il est intéressant de constater que la prévalence de l'HTAP est également de 10% à 20% des cas.Les causes et les mécanismes de l'apparition d'une insuffisance respiratoire chronique (IRC) chez certains SAOS sont cependant loin d'être élucidées. Les facteurs incriminés sont :
- la sévérité du SAOS
- l'existence d'une éventuelle diminution de la chémosensibilité chez certains de ces patients
- le rôle de l'obésité et, enfin,
- le rôle d'une broncho-pneumopathie chronique obstructive (BPCO) associée.
L'obésité représente quant à elle un facteur non négligeable d'IRC dans le SAOS. L'hypoventilation alvéolaire survenant chez de grands obèses s'explique principalement par le coût excessif du travail respiratoire, du fait de la chute de la compliance du système respiratoire et de l'augmentation de la résistance thoracique. La corrélation entre l'élévation du coût en oxygène de la ventilation et le niveau de la PaCO2 est très significative chez les obèses. La fréquence de l'hypercapnie n'est pas plus grande chez les grands obèses (IMC > 40 kg/m2) avec SAOS que chez les autres.
Il ressort, en fait, de la plupart des travaux récents que l'obstruction chronique des voies aériennes distales est un facteur déterminant de l'IRC diurne dans le SAOS. L'association BPCO-SAOS est retrouvée dans 11% des cas. Dans les équations de régression multiple, le VEMS est le meilleur prédicteur de la PaO2 et de la PaCO2 chez les patients porteurs d'un SAOS; il est également un bon prédicteur du niveau de pression artérielle pulmonaire (PAP). Il reste que l'existence d'une BPCO est souvent méconnue et qu'elle peut être asymptomatique. Elle doit donc être systématiquement recherchée par des EFR. Elle représente sans doute le facteur déterminant de survenue d'une hypoventilation alvéolaire dans la plupart des cas de SAOS.
EFFETS CARDIOVASCULAIRES CHRONIQUES
Il n'y a actuellement pas de preuve que le SAOS, en l'absence d'hypoxémie ou d'hypoxémie-hypercapnie diurne, soit capable d'induire une HTAP permanente. L'HTAP est une conséquence de l'hypoxie alvéolaire prolongée tant nocturne, prononcée, que diurne, modérée. En outre, cette HTAP est le plus souvent modérée. Cette HTAP modérée n'exclut cependant pas le développement d'une insuffisance cardiaque droite à la faveur d'une surinfection broncho-pulmonaire aiguë.Le système nerveux autonome (SNA) joue un rôle essentiel dans les mécanismes physiopathologiques à l'origine des conséquences cardio-vasculaires aiguës et chroniques du SAOS. Il apparaît, en fait, une élévation chronique du tonus adrénergique chez ces patients. La stimulation hypoxique répétée et l'obésité sont elles mêmes associées à une augmentation de l'activité sympathique et pourraient constituer des facteurs confondants essentiels. Mais, on a pu montrer que le tonus adrénergique est augmentée de façon significative chez les patients obèses ayant un SAOS modéré (IAH moyen = 19) et très peu de désaturations nocturnes (SaO2 moyenne = 97%) ; en outre, l'obésité sans apnées n'est pas associée à une augmentation du tonus adrénergique à destinée musculaire. Les mécanismes de cette activation sympathique sont donc loin d'être élucidés. En outre, les sujets apnéiques développent une sensibilité cardio-vasculaire excessive à la stimulation sympathique de part la modification de la réponse endothéliale, avec un déficit de la vasodilatation NO-dépendante. Le SAOS est également associé à une réduction du tonus parasympathique. Les mécanismes à l'origine de ces réponses vagales anormales ne sont pas élucidés.
Des études chez l'animal ont pu montrer que la répétition d'événements apnéiques sur plusieurs semaines était capables d'induire une HTA permanente, la survenue de celle-ci nécessitant une hypoxémie associée aux apnées – avec un système sympathique et des chémorécepteurs carotidiens intacts. La reprise ventilatoire postapnéique entraîne une hyperventilation, qui, si les réponses chémosensibles sont préservées, induit une hyperoxie transitoire et relative. Cette dernière génère un effet vasoconstricteur systémique qui va, en se répétant à chaque hypoxie intermittente, contribuer à modifier la structure endothéliale et augmenter de façon permanente les résistance vasculaires périphériques. En effet, la désactivation du chémoréflexe par inhalation de 100% d'oxygène durant 15 minutes entraîne une baisse significative du tonus sympathique musculaire et de la pression artérielle moyenne chez les patients apnéiques.
-
TRAITEMENT DU SYNDROME D'APNÉES DU SOMMEIL
En France, les caisses d'assurance maladie prennent en charge les patients atteints d'un SAS sévère se plaignant d'hypersomnolence et d'au moins trois des signes suivants : ronflements, nycturie, céphalées matinales, troubles de la libido, hypertension artérielle. Ces signes doivent s'accompagner soit d'un IAH > 30 soit d'un IAH > 20 avec la survenue d'au moins 10 micro-éveils par heure de sommeil - micro-éveils liés aux événements respiratoires nocturnes.
TRAITEMENTS MÉDICAUX
Considérée actuellement comme la méthode de référence, la pression positive continue (PPC) a l'avantage de ne pas modifier l'anatomie et donc, d'être peu agressive à l'opposé de l'ancien traitement de référence qui était la trachéotomie. La pression positive correspond à une pression supérieure à la pression atmosphérique appliquée de façon continue par voie nasale ou nasofaciale, qui empêche l'occlusion des VAS et donc, l'apparition des apnées dans le sommeil. Elle ne présente aucune contre-indication et pas d'effets secondaires majeurs hormis :
- Une possible irritation locale liée au port du masque
- Des phénomènes d'hypersécrétion nasale avec rhinite
- Des phénomènes de conjonctivite liés à des fuites au masque
- Un ass
TRAITEMENTS CHIRURGICAUX
Le traitement chirurgical vise à une levée radicale de l'obstacle oropharyngé. Il s'adresse tant au SAOS avec site obstructif spécifique qu'au SAOS sans site obstructif évident. Dans ce dernier cas, il tente soit :
- de diminuer le volume des tissus mous (voile du palais, amygdales, base de la langue) limitant les parois de l'oropharynx
- de transférer vers l'avant les insertions de la langue et/ou les insertions du voile.
- aux difficultés de l'évaluation préopératoire du site obstructif
- au caractère multifactoriel du SAOS. èchement de la muqueuse oropharyngée.
TRAITEMENT CHIRURGICAL DU SAOS SANS SITE OBSTRUCTIF SPÉCIFIQUE
La difficulté majeure est de sélectionner les patients ayant un site obstructif unique, vélo-amygdalien ou rétro-lingual, des patients ayant une atteinte bifocale.
TRAITEMENTS CHIRURGICAUX DES TISSUS MOUS DE L'OROPHARYNX
- L'uvulo-palato-pharyngoplastie (UPP) ou pharyngotomie. Elle consiste en une excision de la luette, du voile du palais, des amygdales, et, éventuellement, d'une partie de la muqueuse de la paroi postérieure du pharynx, le but étant de restaurer une perméabilité normale des VAS. Les suites opératoires sont marquées par un syndrome algique important, des risques hémorragiques per- et postopératoires, des reflux liquidiens, une voix nasonnée, une dysphagie, des infections et la possibilité, à plus long terme, d'une sténose ou d'une insuffisance vélaire liée à un défaut de technique. Le taux d'efficacité subjective sur le ronflement est, en moyenne, supérieur à 80%. Si l'on considère un IAH inférieur à 10 comme critère de succès, le taux d'efficacité sur la régression des apnées est compris entre 40 et 50%. Une grande obésité (IMC > 30 kg/m2), un IAH élevé (> 30) et un âge avancé sont des facteurs prédictifs d'un échec de l'UPP.
- La pharyngotomie par laser ambulatoire. Apparue au début des années 90, cette technique a connu un développement important de part son faible coût et sa réalisation en ambulatoire. Elle ne peut pas être proposée en cas d'hypertrophie des amygdales et ne permet pas une plastie d'élargissement de l'oropharynx. Principalement indiquée dans le traitement des ronchopathies, elle donne un taux d'efficacité sur le ronflement à peu près identique à celui obtenu par la pharyngotomie classique.
- Les chirurgies linguales ont été développées en réponse à l'échec des chirurgies du voile du palais dans le cas des obstructions des VAS situées en arrière de la base de la langue.
CHIRURGIES OSSEUSES HYOÏDIENNES OU MAXILLO-MANDIBULAIRES
La chirurgie hyoïdienne consiste à antérioriser l'os hyoïde. La transposition génienne vise à antérioriser les insertions de la langue. Les avancées maxillo-mandibulaires tentent d'antérioriser dans le même temps opératoire la mandibule et le maxillaire supérieur. La chirurgie maxillo-mandibulaire est une chirurgie efficace avec un taux de succès variant entre 65 et 100% pour un IAH postopératoire inférieur à 10.
La chirurgie du SAOS a été largement dominée par l'UPP. L'échec de cette chirurgie, en particulier pour les SAOS moyens ou sévères, comme le pourcentage non négligeable de patients abandonnant le traitement par PPC ont conduit les équipes chirurgicales à proposer divers traitements de l'oropharynx inférieur rétro-basilingual. Si les taux de succès des chirurgies du SAOS sont bien inférieurs à ceux de la PPC, il ne faut pas oublier qu'elles s'adressent à des patients le plus souvent en impasse thérapeutique pour lesquels il n'y a pas d'autre solution hormis les orthèses. Restent :
Le traitement postural visant à empêcher le patient de dormir en décubitus dorsal, efficace dans certains cas de SAOS peu sévères et dépendant de la position nocturne du patient
La chirurgie nasale indiquée quand elle permet une meilleure tolérance à la PPC ou en association avec les autres chirurgies du SAOS. Elle vise à la reperméation des fosses nasales par redressement du septum, résection de cornets nasaux hypertrophiques ou ablation de polypes nasaux.
L'envoi d'air à une pression suffisante pour maintenir les voies aériennes supérieures ouvertes malgrè la diminution du tonus musculaire des muscles dilatateurs du pharynx dans le sommeil permet la disparition des apnées. L'instauration du traitement nécessite une PSG de titration permettant de régler le niveau de pression nécessaire à la disparition des apnées et de la ronchopathie comme à la restauration de l'organisation générale du sommeil. Le niveau de pression efficace doit être déterminé dans tous les stades de sommeil et dans toutes les positions du corps, en particulier le décubitus dorsal; il doit être systématiquement vérifié en sommeil paradoxal, et plus particulièrement en fin de nuit où le risque de récidive des troubles respiratoires est important; il est généralement établi entre 8 et 12 cm d'H2O avec des valeurs extrêmes de 5 à 18 cm d'H2O.
Dès la première nuit de traitement sous PPC, on observe une augmentation importante de la proportion en sommeil lent profond et en sommeil paradoxal, avec souvent un phénomène de rebond; le réveil s'accompagne d'une sensation de repos inhabituelle, de sommeil récupérateur avec une régression de l'hypersomnolence diurne, bon facteur de pronostic quant à l'observance future du traitement. Le rebond en sommeil lent profond et en sommeil paradoxal peut se poursuivre pendant toute la première semaine de traitement avant d'observer une normalisation complète de l'architecture du sommeil. Cependant, une étude récente comparant PPC contre placebo (PPC à une pression inefficace) montre des résultats très inattendus avec, au bout de 7 jours de traitement, une réelle efficacité de la PPC sur les événements respiratoires nocturnes, sur les micro éveils et sur la saturation nocturne sans amélioration de la qualité du sommeil. La plupart des études mettent néanmoins en évidence une amélioration significative de la latence d'endormissement au test itératif de latence d'endormissement ou au test de maintien de l'éveil sous PPC et ce, par rapport à l'état initial. Des résultats préliminaires pourraient faire évoquer une amélioration des chiffres tensionnels et ce indépendamment d'un amaigrissement concomitant mais associée à une correction de la saturation en oxygène et à une diminution de la sécrétion de catécholamines, l'effet du traitement par PPC sur l'hypertension artérielle restant à confirmer.
Quoiqu'il en soit, l'utilisation de la PPC s'accompagne d'une réduction de la mortalité comparable à celle obtenue après trachéotomie et supérieure au traitement chirurgical conventionnel ou après perte de poids isolée. En outre, elle améliore significativement, après 9 mois de traitement, les tests de performance lors d'une simulation de conduite automobile et ce, sans différence par rapport à un groupe témoin de sujets sains et réduit les accidents de circulation. L'amélioration de la qualité de vie et la disparition de l'angoisse des conjoints vis-à-vis des apnées nocturnes jouent un rôle dans la tolérance et l'observance du traitement.
Toute la limitation du traitement repose, en fait, sur la contrainte journalière qu'il impose aux malades. Après la première PSG de titration, le taux d'acceptation de la PPC varie entre 70 et 80%. A distance, 80 à 90% des patients continuent d'utiliser leur appareil à domicile avec, cependant, des durées d'utilisation très variables.
La qualité de l'observance est liée principalement à la qualité de la prise en charge des patients lors des premiers jours du traitement et avant leur retour à domicile. Elle dépend également de la gravité du SAOS et du degré d'hypersomnolence diurne initiaux.
TRAITEMENT CHIRURGICAL DU SAOS AVEC SITE OBSTRUCTIF SPÉCIFIQUE
Bien que rare, l'existence d'un site obstructif spécifique doit être recherché d'emblée chez un patient suspect de SAOS, nécessitant un examen ORL systématique. Les pathologies tumorales, bénignes ou malignes, de la base de la langue, de l'épiglotte ou des amygdales, les pathologies malformatives telles que les micrognathies, les séquelles traumatiques en particulier au niveau de l'articulation temporo-mandibulaire, une hypertrophie de la base de la langue dans le cadre d'une acromégalie, les pathologies laryngées obstructives sont autant de cas spécifiques nécessitant une prise en charge adaptée.
LES RÈGLES HYGIÉNO-DIÉTÉTIQUES
L'objectif principal est la perte de poids. Ces mesures n'ont fréquemment qu'une efficacité incomplète et temporaire. Les règles hygiéno-diététiques visent à supprimer ou à limiter les facteurs qui favorisent l'obstruction pharyngée, tels que le surpoids, la prise de boissons alcoolisées, le tabac, les somnifères et le sommeil en décubitus dorsal. La perte de poids peut entraîner une amélioration clinique mais son efficacité sur l'élimination des apnées est moins certaine et concerne surtout les obésités morbides.
TRAITEMENT CHIRURGICAL DU SAOS AVEC SITE OBSTRUCTIF SPÉCIFIQUE
Bien que rare, l'existence d'un site obstructif spécifique doit être recherché d'emblée chez un patient suspect de SAOS, nécessitant un examen ORL systématique. Les pathologies tumorales, bénignes ou malignes, de la base de la langue, de l'épiglotte ou des amygdales, les pathologies malformatives telles que les micrognathies, les séquelles traumatiques en particulier au niveau de l'articulation temporo-mandibulaire, une hypertrophie de la base de la langue dans le cadre d'une acromégalie, les pathologies laryngées obstructives sont autant de cas spécifiques nécessitant une prise en charge adaptée.
LES ORTHÈSES ENDOBUCCALES
Les orthèses endobuccales représentent une alternative aux traitements habituellement proposés et à la PPC en particulier. En effet, en France, la PPC est réservée aux patients dont l'IAH est supérieur ou égal à 30 ou, maintenant, à ceux dont l'index est inférieur à 30 avec un index de micro éveils nocturnes liés aux apnées-hypopnées supérieur à 10 par heure. Doivent s'associer à cet IAH un cortège de symptômes témoignant d'une déstructuration du sommeil. En outre, une mauvaise acceptation psychologique de la PPC peut aboutir, chez certains patients, à un arrêt du traitement ou, pour tout le moins, à une mauvaise compliance responsable de la persistance de la symptomatologie initiale tant diurne que nocturne. Les résultats actuels orientent plutôt vers la possibilité de la prise en charge par orthèse endobuccale des formes peu sévères ou modérées de SAOS. Le but de ces orthèses est d'agrandir et/ou de stabiliser les VAS pendant le sommeil. Seuls l'avancement mandibulaire et la protrusion de la langue ont montré une efficacité clinique.
Les orthèses d'avancement mandibulaire avancent la mandibule de 5 mm environ pour agrandir la filière aérienne pharyngée postérieure, écartant les structures anatomiques collabables entre elles. On solidarise, par une orthèse monobloc ou bibloc, la mandibule physiologiquement mobile au maxillaire fixe par des gouttières fixées aux arcades dentaires et solidarisées entre elles. Une revue de la littérature fait état de 73 à 100% de réussite chez les ronfleurs. Il reste que peu d'études rapportent une analyse objective de cette amélioration, qui est inversement proportionnelle à la gravité du SAOS concomitant à la ronchopathie. Sur le plan des apnées, 70% des patients voient leur IAH diminuer de 50%, 51% d'entre eux avec un IAH inférieur à 10. Il existe ici aussi une relation inversement proportionnelle entre le niveau de gravité initiale et la diminution de l'IAH. De fait, des études récentes ont comparé les effets et la tolérance des orthèse d'avancement mandibulaire au traitement par PPC ; dans le cas des SAOS peu sévères à modérés, les conclusions sont à l'avantage des orthèses, la PPC conservant toute sa place dans les formes sévères. Les effets secondaires sont :
- Une hypersialorrhée
- Un inconfort dentaire après l'éveil
- Une sécheresse de la bouche
- Et surtout, des douleurs au niveau des articulations temporo-mandibulaires.
Les orthèses de protrusion de la langue avancent la masse linguale en libérant l'espace pharyngé postérieur soit en tirant soit en poussant sur la langue. Les différentes études rapportent une diminution de l'IAH d'environ 50% et ceux chez les patients particulièrement compliants. Globalement, ces dispositifs sont mal tolérés avec algies de la langue et hypersialorrhée diminuant la tolérance.
Aucun commentaire:
Enregistrer un commentaire